Spesifikk varmetabell for stoffer
Denne artikkelen laget av Itieffe representerer en grunnleggende ressurs innen termodynamikk og materialvitenskap, og tilbyr en detaljert oversikt over de termiske egenskapene til forskjellige stoffer.
Dette dokumentet tar sikte på å klart og konsist forklare konseptet spesifikk varme og gi meningsfulle data om en rekke materialer, hjelpe studenter, forskere og ingeniører å forstå hvordan forskjellige stoffer reagerer på endringer i temperatur og gi viktig informasjon for utformingen av termiske og energisystemer. .
I denne introduksjonen ønsker vi å understreke viktigheten av spesifikk varme som en grunnleggende parameter for termisk karakterisering av materialer. Spesifikk varme representerer mengden termisk energi som trengs for å heve temperaturen til en gitt mengde materie med en viss mengde grader Celsius eller Kelvin.
Denne mengden er avgjørende for et bredt spekter av bruksområder, fra design av elektriske motorer og kjølekretser til beregning av energibehov i industrielle prosesser.
Hovedtrekkene og emnene som tas opp i denne artikkelen inkluderer:
- Definisjon av spesifikk varme: vi vil forklare i detalj hva spesifikk varme representerer og hvordan den måles eksperimentelt.
- Måleenhet: vi skal illustrere måleenhetene for spesifikk varme og hvordan de brukes i termodynamiske formler.
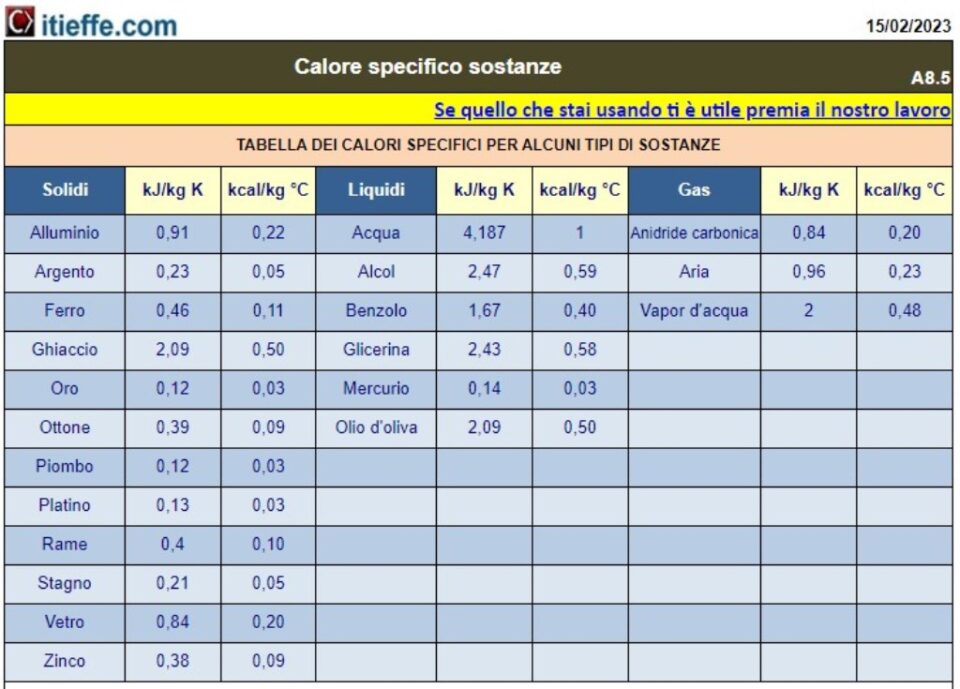
- Spesifikk varme av forskjellige stoffer: vi vil gi en liste over spesifikke varme for et bredt spekter av vanlige materialer, inkludert metaller, væsker, gasser og andre.
Hovedmålet med denne artikkelen er å gi et fullstendig bilde av konseptet spesifikk varme og dets praktiske anvendelser, hjelpe leserne til å forstå hvordan forskjellige stoffer reagerer på endringer i temperaturen og å ta informerte valg i design og optimalisering av termiske og energisystemer. .
Kunnskap om stoffers spesifikke varme er avgjørende for en rekke vitenskapelige og ingeniørfaglige disipliner, noe som bidrar til teknologisk fremgang og energieffektivitet.
Spesifikke varmestoffer
Spesifikke varmestoffer
Mengden energi som en varm kropp overfører til en kaldere avhenger ikke bare av forskjellen mellom de to temperaturene, men også av massen til den varmere kroppen. Faktisk er energien som strykesålen til et strykejern kan overføre mye større enn den som en stift kan overføre ved samme temperatur. Varme er derfor en omfattende mengde materie. Dens måleenhet er den samme som energi, som i SI er joule. Effekten forårsaket på en kropp av en viss mengde varme avhenger av kroppens natur.
Når vi for eksempel varmer opp 1 kg vann og 1 kg jern med like store mengder varme, registrerer vi forskjellige slutttemperaturer. Det følger at ettersom kroppens natur varierer, varierer mengden varme som er nødvendig for å øke temperaturen på 1 kg masse med 1 K. Denne varmemengden kalles spesifikk varme.
Spesifikk varme er mengden energi som absorberes (eller frigjøres) av 1 kg materiale som forårsaker en 1 K økning (eller reduksjon) i temperaturen.
Måleenhet
Måleenheten for spesifikk varme, som er en avledet mengde, er J/kg K i SI. Enhetene J/g K (eller °C), og cal/g °C brukes også ofte, for vann er det , for eksempel 4186 J/kg K, som tilsvarer 4,186 J/g °C og 1 cal/g °C
Den spesifikke varmen til vann er veldig høy: det vil si at det trengs mye energi for å oppnå små temperaturøkninger. Den spesifikke varmen til kobber er derimot ganske liten, så små mengder energi forårsaker store temperaturøkninger. Instrumentet som lar deg måle mengden energi som overføres er kalorimeteret: mengden energi som overføres er kalorimeteret: denne enheten registrerer endringene i temperaturen som overføringen av energi forårsaker på en viss kropp, vanligvis vann.
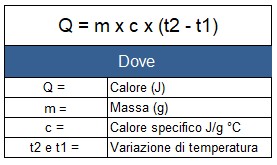
Tatt i betraktning massen, den spesifikke varmen og temperaturforskjellen, kan energien beregnes med følgende formel:
Spesifikke varmestoffer
Programmet nedenfor er gratis å bruke.
For å få tilgang til den reserverte versjonen (se nedenfor), helside og uten reklame, må du være registrert.
Du kan registrere deg nå ved å klikke HER